

復旦大學附屬腫瘤醫院病理科李媛主任團隊與復星杏脈合作的科研論文A new AI-assisted scoring system for PD-L1 expression in NSCLC (人工智能輔助非小細胞癌(NSCLC)PD-L1表達評分系統),獲得國際權威期刊Computer Methods and Programs in Biomedicine(CMPB,影響因子7.03, JCR:Q1區)發表。CMPB涵蓋了源自計算科學的計算方法和軟件系統,用于在生物醫學研究和醫學實踐的各個方面實施。

肺癌是世界范圍內死亡率第一的惡性腫瘤,其中非小細胞肺癌占85%。【1】
全國腫瘤登記中心2022年發布數據顯示:2020年我國新發肺癌病例81萬,占中國新確診癌癥人數的17.9%。
有效篩選PD-1/PD-L的潛在獲益人群,為PD-1抗體實現免疫治療的關鍵,腫瘤細胞通過高表達的PD-L1與T細胞表面PD-1結合,抑制T細胞引發的免疫效應,實現免疫逃逸。截至目前,三種針對PD-1的藥物,通過FDA的批準在美國以及其它國家上市用于癌癥治療。其中兩種(O藥和K藥)已經獲批在國內上市。
PD-1/PD-L1抑制劑在臨床實踐面臨問題包括:治療周期長,費用高, 其中相關研究顯示約20%的患者獲益[2]。 國內外對PD-L1的蛋白表達主要采用免疫組化檢測,PD-L1表達水平可作為一種免疫治療預測及預后標志物,用于篩選免疫治療的潛在獲益人群及預測免疫治療療效,因此,準確可靠的PD-L1判讀及判讀結果對篩選優勢人群尤為重要。
近年來,免疫治療已成為NSCLC患者的一種有效的治療方式。程序性死亡-配體1(PD-L1)為NSCLC免疫檢查點之一,對于腫瘤細胞陽性比例評分(TPS,注:TPS=PD-L1膜染色陽性腫瘤細胞數/總腫瘤細胞數*100%)的準確評估仍然具有挑戰性。傳統的病理醫生視覺評估大多采用估值方式,無法完整計算整張玻片上的所有腫瘤細胞數目,導致診斷的結果不夠精準,無法進一步與治療方式進行更加緊密的關聯研究,而且病理醫生的判斷主觀性較強、個體差異較大。
AI輔助的數字化病理診斷就可以幫助病理醫生來降低這種主觀因素導致的個體之間的一致性差異,可以幫助他們做出更好的治療決策。最近,各種類型的研究已經證明了基于深度學習的方法能夠自動評估TPS。但是,目前的方法仍存在兩方面的不足。首先,由于訓練具有競爭力的深度神經網絡模型依賴于大規模、高質量的標注數據,之前的絕大部分的標注都是在patch水平或者Field of view水平上進行的。另外,參加與AI輔助評分系統比較的病理學家人數最多僅 5 人,可能導致對比實驗結果的可信度不高,需要更多的病理學家進行更豐富的比較。
在本研究中,我們開發了一種基于深度學習方法用于NSCLC PD-L1表達評估。我們是基于全視野數字病理切片(Whole Slide Imges,WSIs)執行的更廣泛的標注,其中訓練集包含 37308 個PD-L1陽性腫瘤細胞(TC)和 43427 個PD-L1陰性TC,測試集包含115個WSIs。金標準TPS 由兩位具有 PD-L1 TPS評分認證的病理學專家評估,不一致的病例由第三位病理學專家顧問審查。與此同時,將AI的評分結果與11名病理醫生(5名經驗豐富的和6名缺乏經驗的病理醫生)進行了比較。
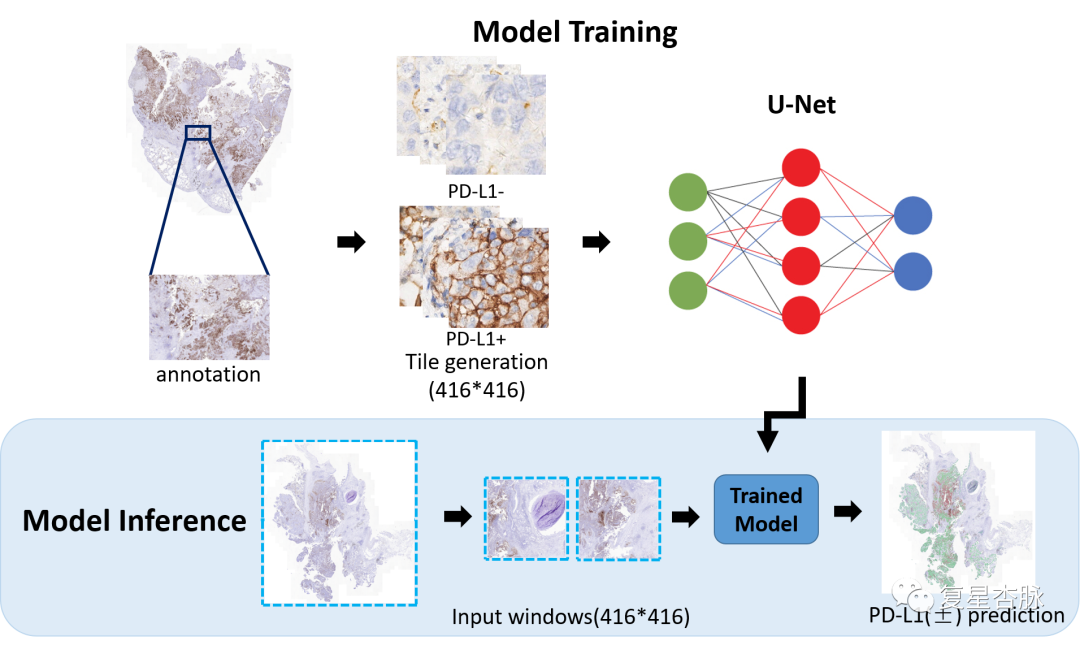
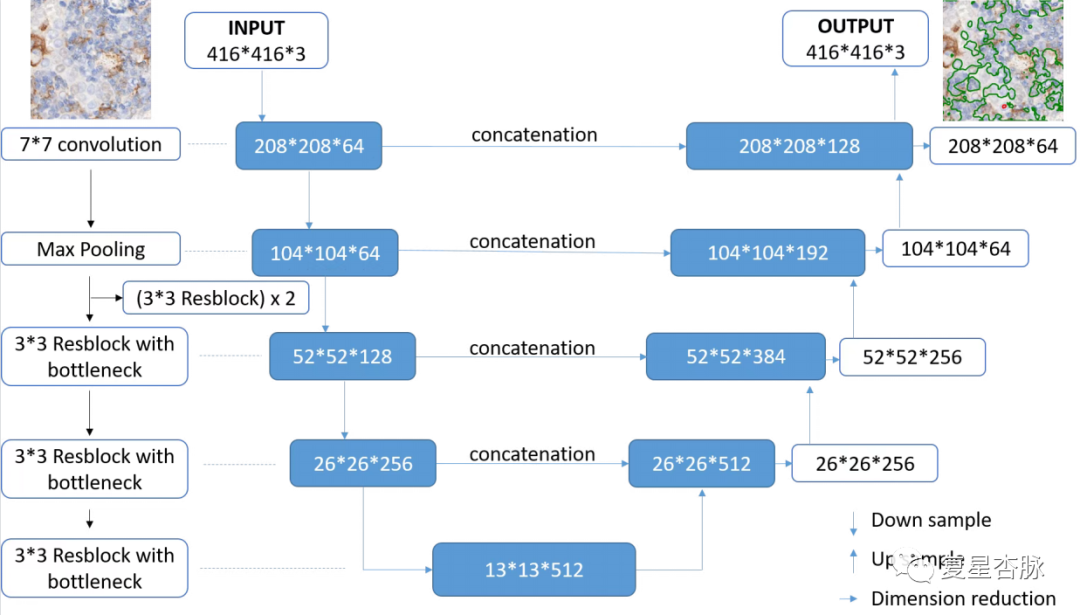
在本研究中, 我們采用一種新的人工智能輔助評分系統用于評估NSCLC PD-L1表達。我們將免疫組化(IHC)圖像的標注區域被平鋪成不重疊的patch(416 × 416 像素),使用 U-net 上采樣和下采樣將細胞輪廓、細胞核等低級特征與正負TC分類的高級特征相結合。此外,相比較傳統的 U-net 架構,我們添加了 res-blocks,可以提高提取特征的能力并解決訓練過程中梯度消失的問題。為了確定 WSI 的 TPS 值,我們提出了如下 3 步方法:(1)分割 WSI 每個patch的陽性和陰性腫瘤細胞; (2)計算陽性和陰性腫瘤細胞的面積,并將這些面積相加,計算出WSI的TPS值; (3) 使用 TPS 計算公式來確定 WSI的TPS 值。
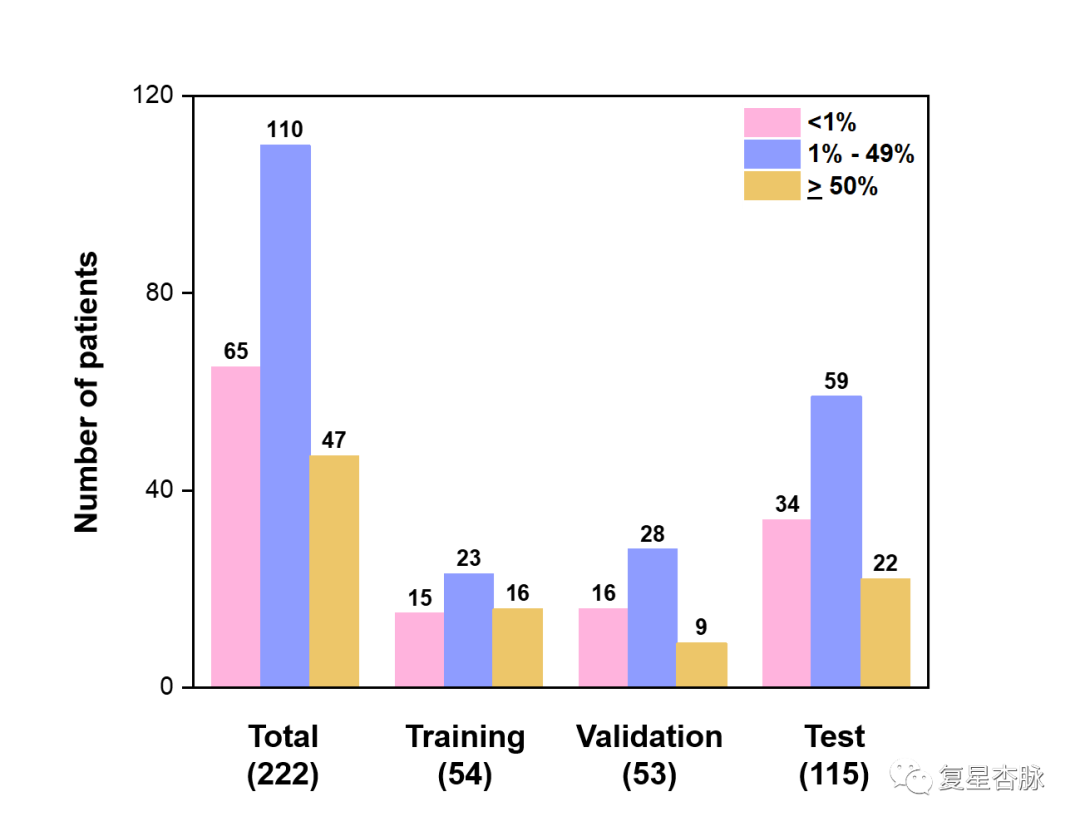
我們入組了2017 年 9 月至 2020 年 12 月期間被確診為 NSCLC的222名患者,訓練、驗證、測試集分別為54、53、115例病人,且每個數據集都包含不同級別的TPS診斷結果。
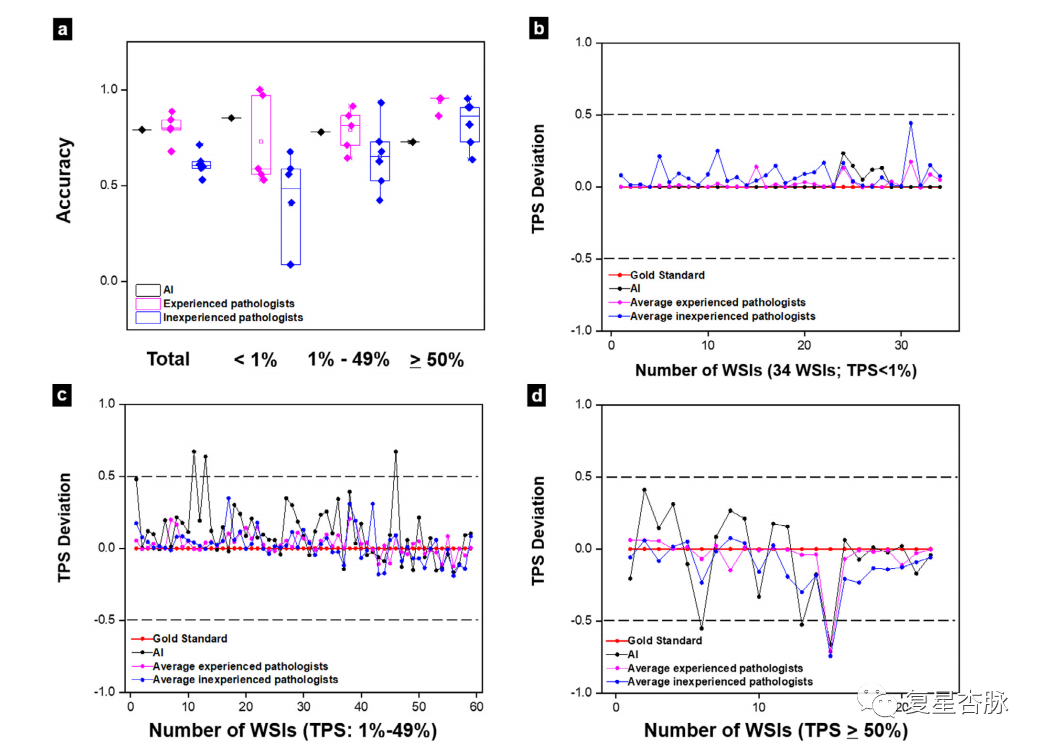
實驗結果表明,在 TPS 陰性(TPS小于1%)子集中,AI的準確度最高(85.29%),優于經驗豐富的病理學家(72.94%)和缺乏經驗的病理學家(40.20%)。總體結果表明AI 模型在測試數據集中的表現優于低年資病理醫生,接近高年資病理醫生。使用基于細胞水平標注的模型訓練和 11 名參與評估的病理醫生表明我們的數據集覆蓋范圍更廣,使得我們得模型更為可信。
研究團隊開發的 Aitrox AI 模型在大多數 TPS 評分中的表現優于沒有經驗的病理醫生,顯示了模型在協助常規病理學家診斷、PD-L1評分具有很好的潛力。開發可應用于臨床的Aitrox AI系統,以輔助病理醫生的診斷工作具有重要的臨床意義。同時在NSCLC的PD-L1的臨床評分過程中,杏脈AI是有效的輔助評分工具。
復星杏脈目前與復旦大學附屬腫瘤醫院病理科開展了多項基礎科學研究,雙方始終堅信科研必須和臨床緊密聯系,深化創新,夯實基礎研究,建設產學研一體化,AI應用場景得到落地。復旦腫瘤醫院病理科是全國腫瘤病理最大的會診中心,年會診病例從2萬例增長至4萬例。70%的對外會診病例來自于長三角地區,起到長三角“龍頭”作用,解決了大量疑難病例的病理診斷。參與國內多個非小細胞肺癌及食管癌相關的指南與共識。近五年來,承擔國家級及省部級等各類科研項目43項,科研經費合計5500余萬元;發表SCI文章155篇。復星杏脈早在2019年“一致性系數94.6%”榮登國際權威全球病理競賽CancerCellularityChallenge冠軍榜首、并與2021-MICCAI-FLARE腹部多器官的分割任務中獲得冠軍。截至2022年6月發表及審稿中的AI臨床前科研項目總計32項,累計SCI期刊影響因子總計336.2分,知識產權超過100余項,項創新項目成功獲得國家重點研發計劃、國家自然科學基金課題、上海市科委、經信委及發改委課題。

復星杏脈作為復星旗下首個獨立孵化的人工智能企業,自2017年成立以來一直保持高速發展的趨勢,團隊已積累超過40種AI疾病模型儲備,與全國500多家醫療機構達成合作。成熟應用已上線放射科、檢驗科、病理科、呼吸科、骨科、心內科、神經科等多個科室。復星杏脈作為復星“創新驅動”戰略尖兵與醫療人工智能產業核心平臺進行布局發展,通過“匠心+創新”,不斷加大科技研發投入。
同時,復星杏脈深入醫療機構與基層健康服務場景探索真實需求,積極完善分級診療的核心場景服務能力如早篩、遠程診療、精準醫療等,致力于全面解決不同的臨床痛點和公衛難題。通過獨樹一幟的“AI+X”產品形態,有效賦能遠程診療體系建設,形成了促進我國分級診療與精準醫療落地的有效解決方案。
[1]Herbst RS, Heymach JV, Lippman SM. Lung cancer[J]. N EnglJ Med, 2008, 360(13): 1367-1380. [2] Ma W, Gilligan BM, Yuan J. Current status and perspectives in translational biomarker research for PD-1/PD-L1 immune checkpoint blockade therapy. J Hematol Oncol. 2016 May 27;9(1):47. doi: 10.1186/s13045-016-0277-y.
“銳影”隨行|上海長征醫院聯合復星杏脈通過人工智能區分肺部磨玻璃結節良惡性科研成果發表
“銳影”隨行|上海長征醫院聯合復星杏脈使用多任務學習與深度影像組學對于肺部CT磨玻璃結節浸潤性進行預測
